摘要
四个CAR-T药物进入CDE开展临床技术审评
恒瑞医药再有4个1类新药进入CDE
信达生物提交首个国产PD-1单抗信迪单抗的上市申请
豪森提交首个国产GLP-1激动剂聚乙二醇洛塞那肽的上市申请
阿斯利康抗癌新药奥利帕利片申报上市
CFDA发布首批通过一致性评价品种目录
承办情况
据MED中国药品审评数据库2.0统计,12月CDE共承办药品注册申请466个。从总体上看,药品注册申请在下半年(除10月份)增长稳定。
图1:2017年1-12月CDE承办药品注册申请情况(按受理号计)
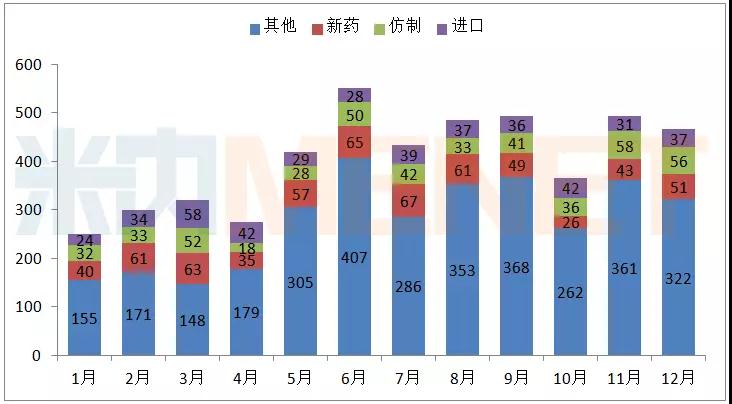
(数据来源:MED中国药品审评数据库2.0,下同)
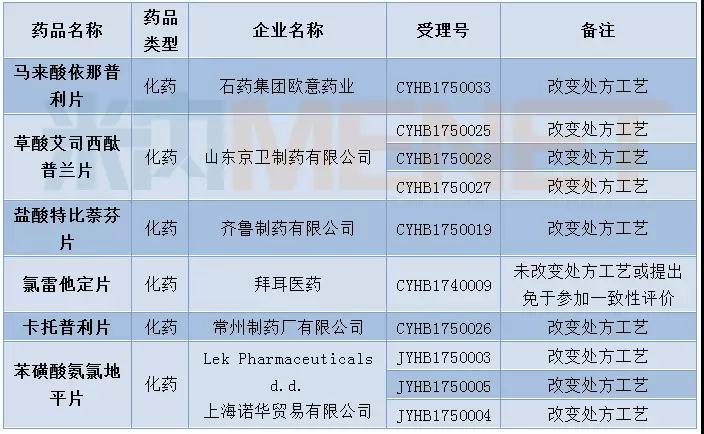
12月有10个一致性评价申请进入CDE,涉及6个品种。
表1:2017年12月仿制药一致性评价受理情况
国内新药承办
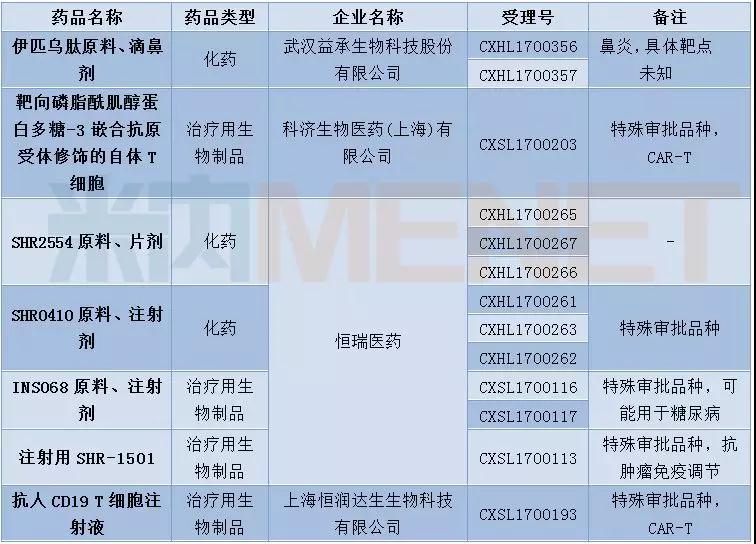
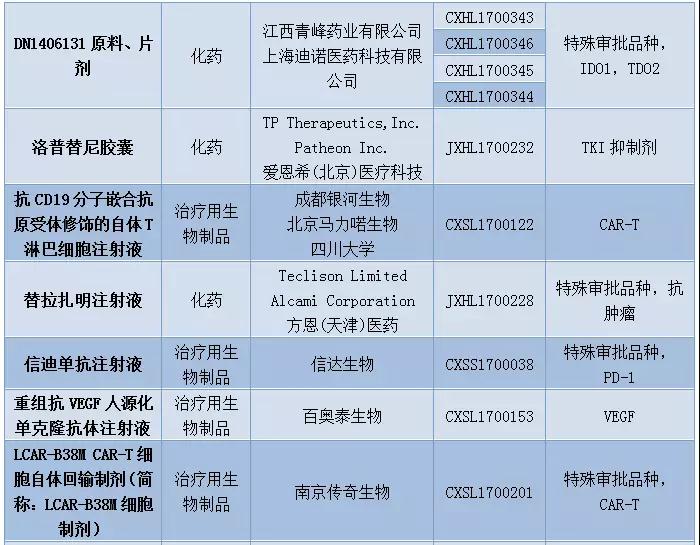
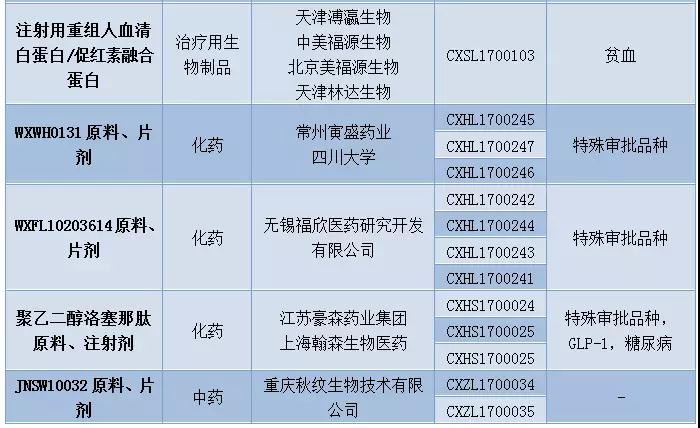
12月新药申请有51个,其中属于1类新药的申请有36个,涉及19个品种。科济生物、上海恒润达生生物科技、南京传奇生物以及成都银河生物的CAR-T药物进入CDE。恒瑞医药再有4个1类新药开始技术审评。豪森药业的GLP-1糖尿病新药聚乙二醇洛塞那肽开始上市技术审评,信达生物也提交了国内首个PD-1单抗信迪单抗注射液的上市申请。
表2:2017年12月1类新药承办情况
仿制申请承办情况
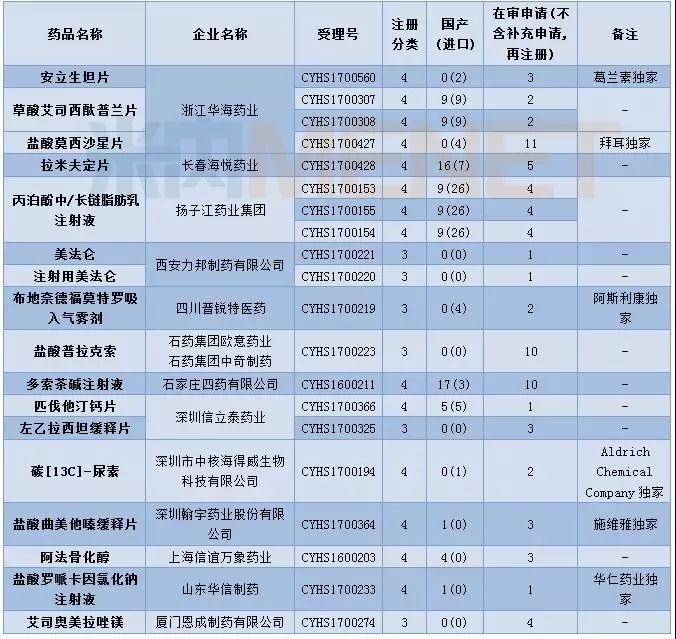
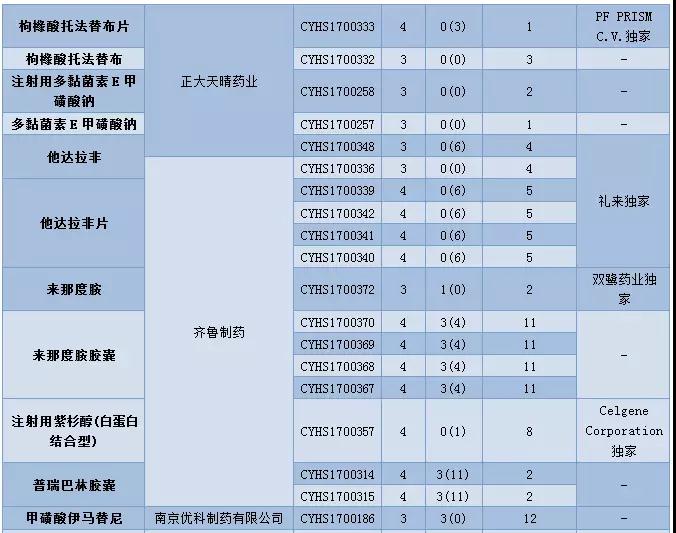
12月CDE供承办仿制申请56个,属于3类的申请有18个,涉及14个品种。4类申请有37个,涉及24个品种。
12月CDE新承办的品种中有17个品种目前为国内独家品种,齐鲁制药提交了来那度胺的仿制申请,成为第三个仿制该品种的企业。
帕瑞昔布钠虽然已有首仿上市,但目前在审竞争仍然激烈,原料药在审申请有23个,注射剂在审申请有37个。
表3:2017年12月仿制申请承办情况
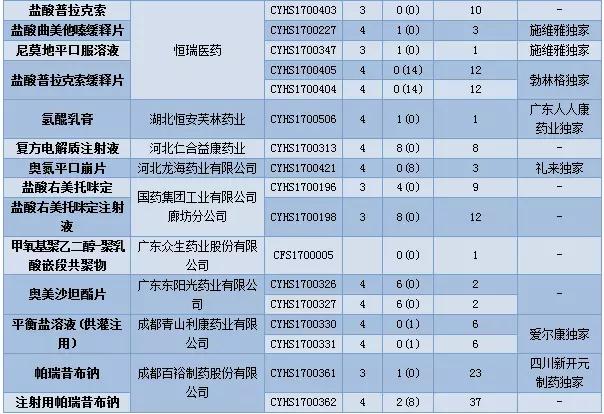
(数据统计截至2018年1月1日)
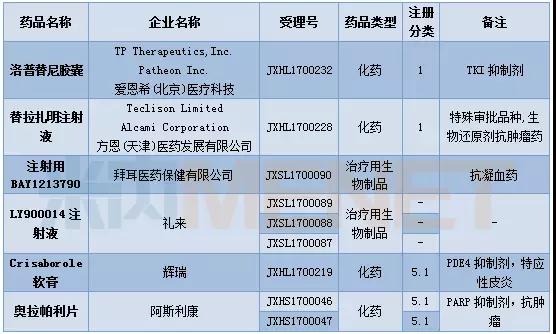
进口申请承办
12月有6个品种被CDE首次承办。洛普替尼是一款TKI(酪氨酸激酶)抑制剂,但具体作用靶点尚未明确。替拉扎明注射液为特殊审批品种,据了解该品种是一款生物还原剂抗肿瘤药。奥拉帕利在2014年被FDA获批上市,是全球首个获批上市的PARP抑制剂,用于治疗卵巢癌。
表4:2017年12月首次承办的进口品种
审批情况
12月有多个1类新药获批临床。
表5:2017年12月1类新药获批情况(仅统计“已发批件”的受理号)
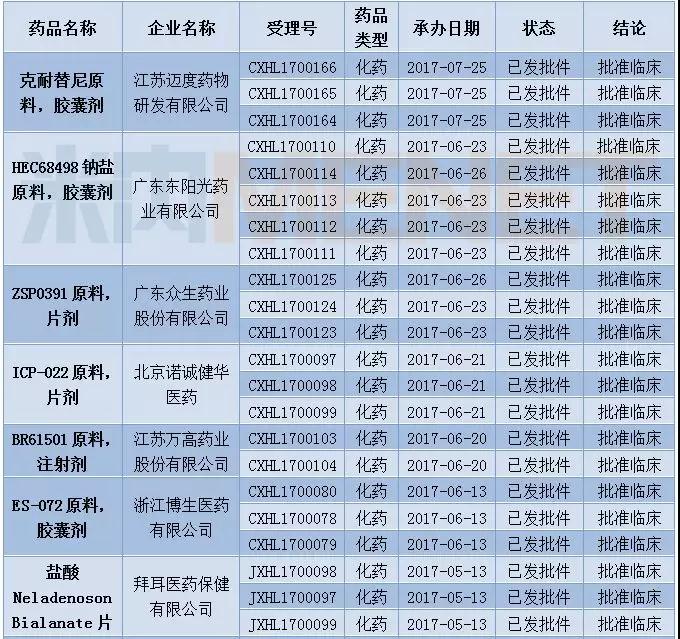
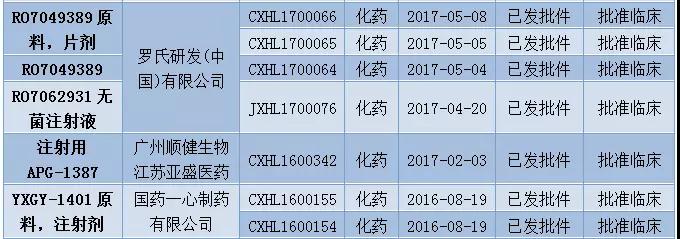
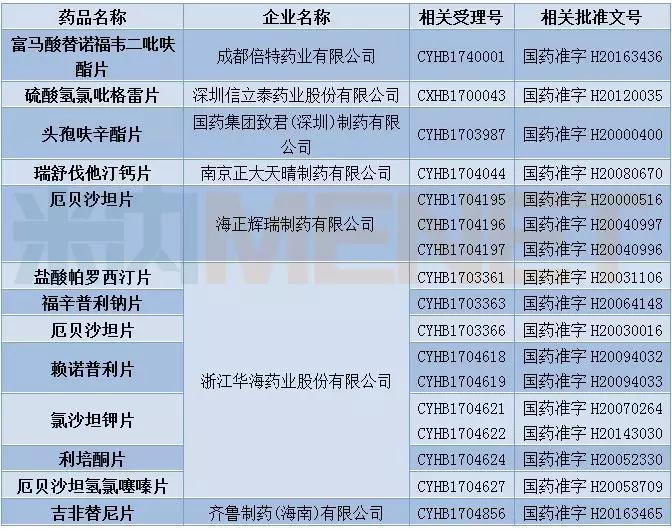
此外,12月CFDA发布了首批通过仿制药质量和疗效一致性评价的品种目录,首批通过仿制药一致性评价的受理号有17个,涉及12个品种,7家企业,浙江华海药业共有7个品种通过一致性评价。
表6:首批通过仿制药一致性评价的药品